
客户服务热线
400-0470-600

微信
13903605303

——粗制样品直接进行TaqMan qPCR扩增,无需核酸纯化
| Tth DNA聚合酶在Mn2+存在的条件下,具有以RNA为模板的逆转录活性,因此可以使用单酶完成RT-PCR扩增,但Tth DNA Polymerase的逆转录活性欠佳,因此在用于RT-PCR扩增时,灵敏度欠佳,无法广泛应用于以TaqMan PCR为基础的基因检测和诊断中。TTx DNA聚合酶源于Tth DNA聚合酶,而逆转录活性较Tth DNA聚合酶大幅提高,在优化的反应Buffer中,TTx表现出卓越的RT-PCR特性,但TTx DNA Polymerase的活性仍然依赖于对PCR有抑制活性的Mn2+,这种专用的反应Buffer系统限制了TTx应用的拓展性。Roche的HawkZ05 Fast DNA Polymerase同样的使用Mn2+作为辅助因子,并配合专用Buffer系统才得以发挥较好的活性。 HaiGene研发团队应用电子重构架技术,改变了mTTx DNA聚合酶的TTx的活性配体中心,使其在Mg2+存在条件下具有极强的逆转录活性,从而获得聚合酶和逆转录活性更强的mTTx DNA/RNA聚合酶。mTTx DNA/RNA Polymerase在Mg2+条件下对于DNA模板和RNA模板的扩增能力几乎无偏差,这种独有的特性使得mTTx不再受限于反应Buffer系统,增加了其应用的拓展性,使得多种类型的实验得以实现。包括: (1). 采用单酶进行TaqMan RT-PCR,在单管相同的Buffer系统中对RNA和DNA进行多重检测。 (2). 在热启动mTTx的条件下,92℃加热5min后,可同步灭活病毒、变性杂蛋白、释放RNA核酸,再进行逆转录和后续的TaqMan RT-PCR扩增。这种特性允许在不进行核酸提取的情况下,直接加入粗制样本进行扩增,我们称为Direct One-Step RT-PCR。 (3). 对比传统的双酶法One-Step RT PCR,由于MLV或AMV具有依赖于DNA的DNA聚合酶活性,在低温恒温逆转录过程中,逆转录酶仍然会造成引物间二聚体扩增和延伸,从而导致热启动DNA聚合酶的性能下降,引起扩增灵敏度受限和假阳性扩增。这种单酶热启动系统完全解决此类问题,甚至可以进行超多重的RNA模板扩增或NGS建库需求。 (4). Mn2+不仅对PCR本身具有抑制作用,还会影响很多种生物酶的活性,如影响下游的连接反应、消化反应、引起酶切反应的星活性(非特异性切割)等。因此,采用Mg2+催化系统会让下游实验更加灵活和便捷。 (5). AMV和MLV均源自高变异的病毒,这决定了逆转录的保真性能较差(均在10-4以下,也就是每合成数千级base就会产生一个突变),而来源于细菌的Tth DNA聚合酶的保真性能在10-5以上(近十万级base才产生一个突变)。除此外,由于PCR扩增中存在Mn2+的条件下,错配会急剧上升,导致突变严重,采用Mn2+作为辅助因子的TTx和HawkZ05 DNA聚合酶均无法用于保真度要求较高的RT-PCR实验中。因此,对保真度要求较高的NGS建库实验来讲,mTTx的这种特性决定了其是最佳选择。 |
||
mTTx DNA/RNA聚合酶的特性 |
||
|
||
mTTx DNA/RNA聚合酶进行Direct One-Step RT-PCR与传统一步法RT-PCR的比较 |
||
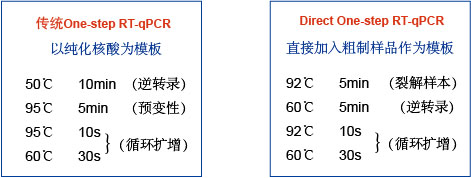 |
||
| 图1,使用mTTx DNA/RNA聚合酶进行Direct One-Step RT-PCR的策略 在使用mTTx DNA/RNA聚合酶的RT-PCR扩增时,可以直接使用粗制样本进行Direct One-Step扩增,粗制样本在92℃加热5min后,核酸释放。再由PCR扩增的反向引物,60℃条件下进行5min的逆转录,再进行PCR扩增。注意:在HaiGene的测试中,在92℃加热5min后,未发现RNA有任何降解情况,CT值不发生变化。 | ||
实例展示 |
||
| 1. 以2019新冠病毒N基因体外转录RNA直接作为模板,应用mTTx RNA Probe RT-qPCR MasterMix对不同拷贝的目标RNA进行TaqMan qPCR扩增,结果表明不同拷贝数的RNA,扩增性能良好。 | ||
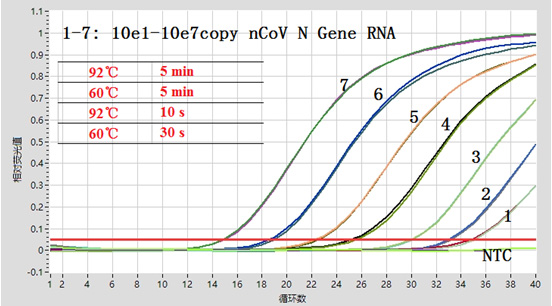 |
||
2. 应用mTTx RNA Probe RT-qPCR MasterMix对不同拷贝的目标DNA和RNA进行TaqMan qPCR扩增,结果表明该产品对DNA模板和RNA模板扩增几乎无偏差,RNA模板比DNA模板更容易检出。 |
||
 |
||
3.将不同数量的Jurkat细胞直接加入到TaqMan PCR反应体系中,应用mTTx RNA Probe RT-qPCR MasterMix进行内参基因GAPDH的TaqMan qPCR扩增。 |
||
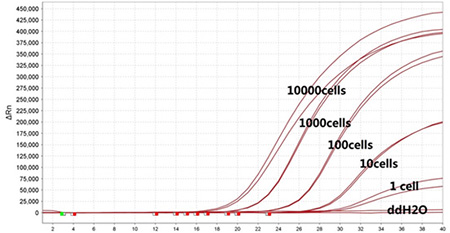 |
||